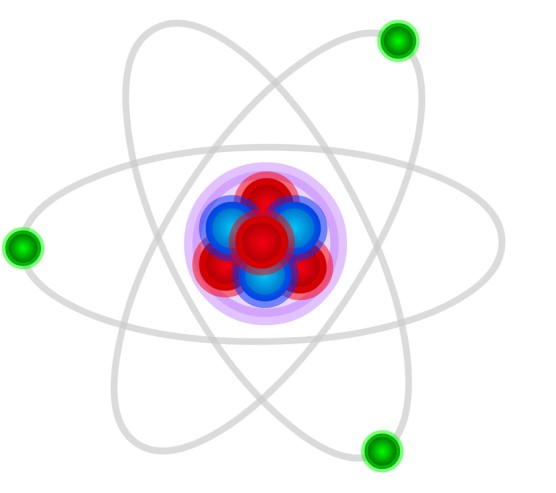
نماذج الذرة
تدقيق لغوي: أ. موانا دبس
قائمة المحتويات
ما هي الذرة؟
إن مصطلح الذرة (Atom) يعني غير قابلٍ للانقسام، وهي كلمةٌ يونانية، وكان العالم ديموقرطس أول من افترض أن المادة مكونةٌ من ذرات، وأنها أصغر الأشياء في الكون، بينما حالياً، فقد علمنا أن الذرة مكونةٌ من بروتونات ونيوترونات (نيكلونات)، حيث تحتوي النيكلونات على جسيماتٍ أصغر تدعى الكواركات.
ما هي النماذج الذرية؟
افترضت العديد من النماذج الذرية التي قادت إلى النموذج الحالي للذرة، ومن هذه النماذج ما يلي:
1- نموذج دالتون
هو أول نموذجٍ اقترح للذرة، حيث افترض العالم دالتون أن المادة مكونةٌ من ذراتٍ غير قابلةٍ للانقسام، وشبه الذرة بكرة مصمتة، كما افترض أن ذرات العنصر الواحد لها خصائص كيميائية، وكتلة متماثلة.
بعد ذلك قام العالم كروكس بإجراء التجربة التالية: أخذ أنبوباً زجاجياً، وفّرغه من الهواء، ووضع في نهايتي الأنبوب قطعتين معدنيتين، ووصلهما بمأخذ جهد (بطارية)، والقطعة المعدنية الموصولة إلى القطب السالب من البطارية تسمّى المهبط (Cathode)، أما القطعة الموصولة إلى القطب الموجب للبطارية تسمّى المصعد (Anode)، وعندما مرّر تياراً كهربائياً لاحظ شعاعاً أخضر اللون صادراً من المهبط باتجاه المصعد، وأطلق على هذه الأشعة تسمية الأشعة المهبطية. [1]
2- نموذج تومسون
قام العالم تومسون بإجراء تعديلاتٍ على تجربة كروكس، حيث قرّب مغناطيساً من أنبوب كروكس، فلاحظ تغيراً في اتجاه الأشعة، وقد استنتج من ذلك أن الذي يصدر من المهبط ليس ضوءاً، وإنما جسيماتٍ سالبة الشحنة، لأنها اتجهت نحو المصعد الموجب الشحنة، وأطلق على هذه الجسيمات تسمية الإلكترونات، وهذه النتيجة قادت العالم تومسون إلى افتراض نموذجٍ للذرة كالتالي:
أن الذرة مكونةٌ من مجموعةٍ من الشحنات الموجبة متوزعةٌ داخل حجم الذرة، وتتوضّع الشحنات السالبة بشكلٍ عشوائي ضمن الذرة بشكلٍ يحقّق التعادل الكهربائي للذرة (مقدار الشحنة الموجبة والسالبة متساويين). [1]
3- نموذج رزرفورد
قام العالم رزرفورد بإجراء التجربة التالية: وجّه جسيمات ألفا إلى صفيحةٍ من الذهب، فلاحظ أن جزءاً من جسيمات ألفا يجتاز الصفيحة، وينفذ منها دون أن ينحرف عن مساره، وقسم ينحرف عن مساره بزوايا صغيرة، وبناءً على هذه التجربة، وضع العالم رزرفورد نموذجه لبنية الذرة كما يلي: [2]
● معظم حجم الذرة فراغ، لذلك نفذ جزءاً من جسيمات ألفا من صفيحة الذهب، وهذا يدحض افتراض تومسون بأن الذرة عبارة عن كرة مصمته.
● تتمركز الشحنة الموجبة في مركز الذرة، وأطلق عليه اسم نواة الذرة، وبناءً على ذلك يعود سبب انحراف جزءٍ من جسيمات ألفا إلى التنافر بين جسيمات ألفا الموجبة الشحنة والنواة، مما يدلّ على أن النواة موجبة الشحنة.
● تدور الإلكترونات حول النواة في مداراتٍ دائرية (كدوران الكواكب حول الشمس)، حيث تدور هذه الإلكترونات بشكلٍ تتساوى فيه قوة التجاذب بين النواة موجبة الشحنة، والإلكترونات سالبة الشحنة، مع القوة النابذة الناتجة عن دوران الإلكترون.
لكن وفق الافتراضية الثالثة، ونتيجة دوران الإلكترون حول النواة سوف يشعّ طاقة، وبالتالي سوف يفقد طاقته بالتدريج، مما يؤدي إلى تناقص نصف قطر مداره، ويتحول من مدارٍ دائري إلى مدارٍ حلزوني، وسيقع الإلكترون في نهاية المطاف في النواة، وهذا يخالف الواقع، كما أن نموذج بور لم يستطع تفسير الخطوط الطيفية.
4- نموذج بور
بقي نموذج رزرفورد الذري سائداً حتى عام 1913، حيث اقترح العالم بور نموذجاً ذرياً معتمداً على نموذج رذرفورد، وافترض ما يلي: [2] [3]
● تدور الإلكترونات حول النواة في مداراتٍ محددة.
● لا يشعّ الإلكترون أي طاقةٍ إذا بقي دائراً في مداره حول النواة.
● عندما ينتقل الإلكترون من مدارٍ أعلى إلى مدارٍ أخفض يشعّ طاقةً مساوية إلى فرق الطاقة بين هذين المدارين.
● عندما ينتقل الإلكترون من مدارٍ أخفض إلى مدارٍ أعلى يمتصُّ طاقةً مساويةً إلى فرق الطاقة بين المدارين.
تمكن بور وفقاً لنموذجه من تفسير الخطوط الطيفية الصادرة من بعض الذرات، لكن المشكلة في هذا النموذج افترض أن للإلكترونات طبيعةً جسيمية.
5- النموذج الذري الحالي
● افترض هذا النموذج أن الذرة تتكون من نواةٍ موجبة الشحنة تحتوي على البروتونات والنيوترونات، وهذه النواة تتمركز فيها معظم كتلة الذرة، ومن إلكتروناتٍ سالبة الشحنة تتحرك بسرعةٍ كبيرة، ولها خواص موجية.
● نصف قطر النواة أصغر بعشرة آلاف مرة من نصف قطر الذرة.
● افترض العالم دي- بروغلي الطبيعة المزدوجة للإلكترون (أي له طبيعية جسيمية وموجية).
● اعتمد على مبدأ الشك لها زنبرغ (في تحديد مكان وسرعة الإلكترون بآنٍ واحد).
● وضع العالم شرودينغر معادلةً يصف خلالها حركة الإلكترون الموجية، ودمج في هذه المعادلة فرضيات دي-بروغلي وهازنبرغ.
يُدعى هذا النموذج بنموذج ميكانيك الكم أو نموذج الغمامات (السحب) الإلكترونية، حيث يفترض أن الإلكترونات تتوضّع في طبقاتٍ أو سوياتٍ طاقية، ويطلق على البروتونات والنيترونات تسمية النيكلونات، ويطلق على مجموع عدد البروتونات والنيوترونات في النواة مصطلح العدد الكتلي أو العدد النيكلوني، بينما يطلق على عدد البروتونات في النواة بالعدد الذري. [1] [4]
المراجع البحثية
1- Martin, A. (2022, August 17). Atomic structure. Online Learning College. Retrieved December 17, 2023
2- 5different Atomic Models- theories, diagram & structure of Atom. (2023, May 12). Testbook. Retrieved December 17, 2023
3- Helmenstine, A. M. (2004, June 28). Basic model of the atom and atomic theory. ThoughtCo. Retrieved December 17, 2023
4- EnthuZiastic. (2023, February 21). Current model of the atom. EnthuZiastic. Retrieved December 17, 2023




Permalink
Permalink
Permalink