النماذج الذريّة الأولى
تدقيق لغوي: أ. موانا دبس
ما هو نموذج ديموقريطس الذري؟
أول النظريات التي تتحدث عن البنية الأساسية للمادة كانت منذ حوالي 400 قبل الميلاد على يد الفيلسوف اليوناني ديموقريطوس (Democritus)، حيث افترض أن كل المواد تتكون من جسيماتٍ دقيقةٍ جداً، وغير قابلةٍ للتقسيم أسماها الآتوم أو الذرات (Atoms)، وإن خصائص هذه الجسيمات هي التي تحدُّد خصائص المادة، وقد حظيت هذه النظرية ببعض الدعم من فلاسفة آخرين، مثل: لوكريتيوس (Lucretius)، لكن طرق التحقُّق منها لم تكن موجودة في ذلك العصر، لذلك لم يتمّ اعتمادها على نطاقٍ واسعٍ لعدة قرون.
وقد عادت هذه الفكرة إلى الظهور في أوائل القرن التاسع عشر لتفسير العديد من القوانين، ومن أشهر تلك القوانين قانون حفظ الكتلة، الذي ذكره لأول مرة العالم الفرنسي بيير لافوازييه (Pierre Lavoisier)، وقانون التركيب الثابت، والذي جاء من ملاحظة أن المركبات تحتوي دائمًا على نفس العناصر بنفس النسب، وقانون النسب المتعددة الذي ينصُّ على أن كتل العناصر المختلفة تتحدُّ دائمًا بنسب أعدادٍ صحيحة صغيرة، وكل تلك القوانين كانت تعتمد بشكلٍ أو بآخر على رؤية ديموقريطس لبناء المادة. [1]
ما هو نموذج دالتون الذري؟
بعد نظرية ديموقريطس بما يقارب من ألفي عام تمَّ وضع أول نموذجٍ حقيقي لبنية الذرة بواسطة جون دالتون (Dalton) عام 1803 م، وترتكز نظرية دالتون الذرية على عدة نقاط: [2]
1- كلُّ المادة مكونةٌ من ذرات، والذرات غير قابلة للتجزئة، وغير قابلة للتدمير.
2- جميع ذرات عنصرٍ معينٍ متطابقةٌ في الكتلة والخصائص.
3- تتكون المركبات من اتحاد نوعين أو أكثر من الذرات.
4- التفاعل الكيميائي هو إعادة ترتيب الذرات.
ونحن نعلم اليوم أن الذرات يمكن تفتيتها عن طريق التفاعلات النووية، ولكن ليس عن طريق التفاعلات الكيميائية. أيضًا، هناك أنواع مختلفة من الذرات (تختلف حسب كتلتها) داخل العنصر، والتي تُعرف باسم النظائر، لكن نظائر العنصر لها نفس الخصائص الكيميائية. العديد من الظواهر الكيميائية غير المبررة حتى الآن فسرها دالتون سريعًا بنظريته، وسرعان ما أصبحت نظرية دالتون الأساس النظري في الكيمياء.

الذرة وفق تصور دالتون
ما هو نموذج طومسون الذري؟
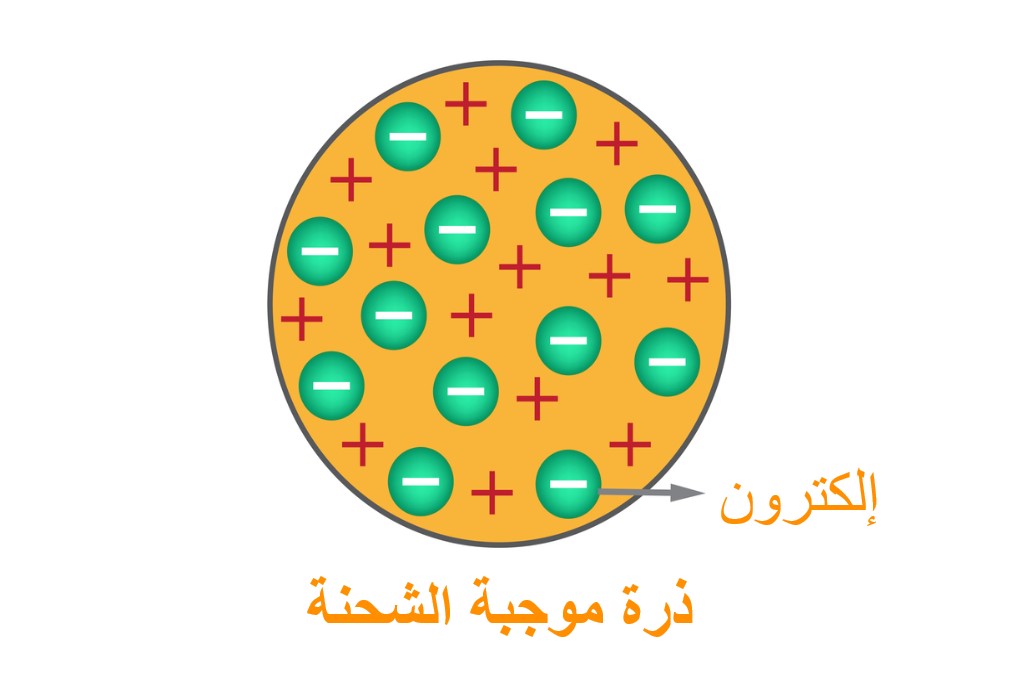
في عام 1897، اكتشف طومسون (Thomson) الإلكترون (Electron) عن طريق تجربة أنبوب كروكس (Crookes) أو الأشعة المهبطية، وأثبت أن الأشعة المهبطية مشحونةٌ بشحنةٍ سالبة. بالإضافة إلى ذلك، قام أيضًا بدراسة الجسيمات الموجبة الشحنة في غاز النيون.
أدرك طومسون أن النموذج المقبول للذرة لا يأخذ في الاعتبار الجسيمات المشحونة سالبًا أو إيجابيًا، لذلك اقترح نموذجًا للذرة شبهه بالبطيخة، والتي تمثل الشحنة الموجبة، والبذور التي بداخلها هي الإلكترونات السالبة. لقد شرح نموذج طومسون للذرة بعض الخواص الكهربائية للذرة بسبب الإلكترونات، لكنه فشل في التعرف على الشحنات الموجبة في الذرة كجُسيماتٍ مستقلة. [3]

المراجع البحثية
1- Democritus: A molecular dynamics simulation. (n.d.-b). Ucl.ac.uk. Retrieved November 12, 2023
2- Dalton’s atomic theory. (n.d.). Retrieved November 12, 2023
3- Development of the atomic theory. (n.d.). Abcte.org. Retrieved November 12, 2023




Permalink