النماذج الذرية الحديثة
تدقيق لغوي: أ. موانا دبس
قائمة المحتويات
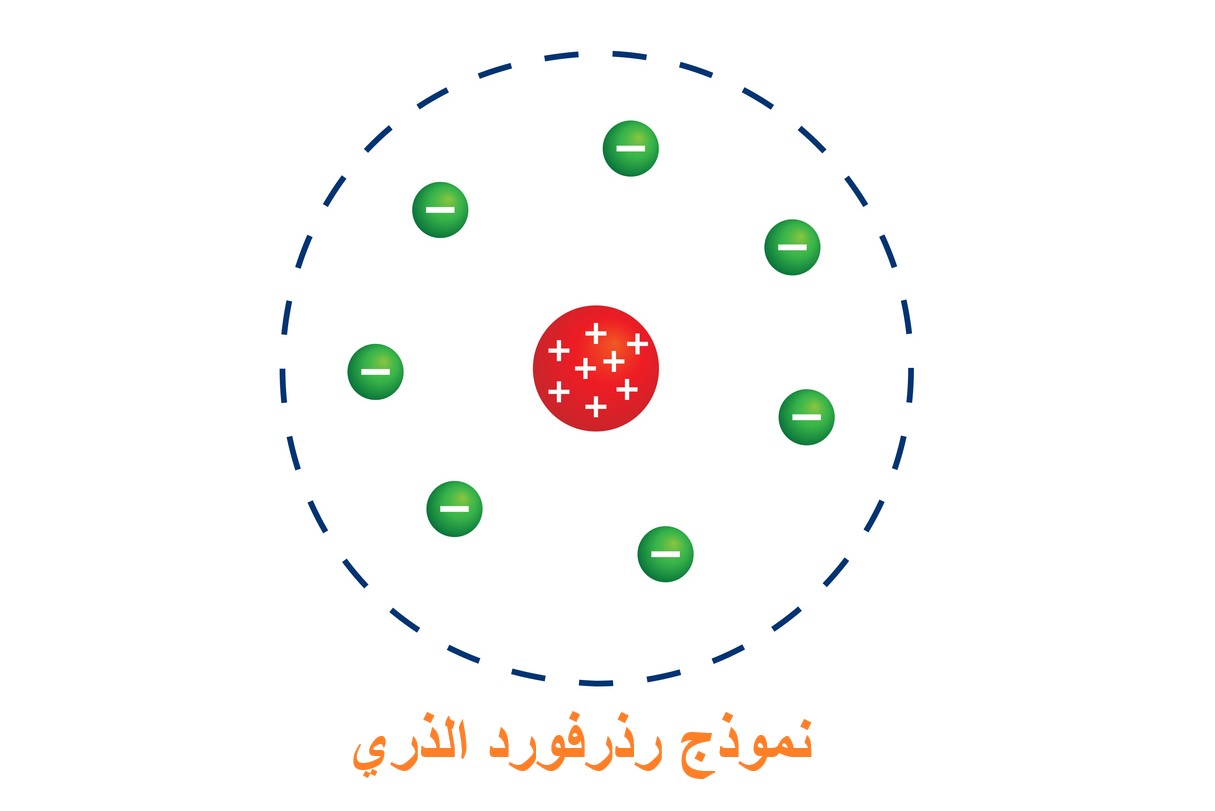
ما هي نظرية روذرفورد في التركيب الذري؟
في عام 1911، أرنست رذرفورد (Rutherford)، وهو طالبٌ سابقٌ لدى طومسون، وقد أثبت أن بنية نموذج طومسون غير دقيقة، حيث أجرى رذرفورد وفريقه سلسلةً من التجارب لاكتشاف البنية الداخلية للذرة عن طريق إطلاق جسيمات ألفا (جسيمات تمثل نوى ذرات الهليوم)، حيث سلّط رذرفورد حزمةً من جسيمات ألفا على صفيحةٍ رقيقةٍ من الذهب، ووضع خلف الصفيحة كاشفاً يبين مكان سقوط جسيمات ألفا بعد أن تجتاز الصفيحة.
لاحظ رذرفورد أن معظم جسيمات ألفا تمرُّ مباشرةً عبر صفيحة الذهب دون أن تنحرف، كما لو كانت تمرُّ في شيءٍ فارغ، وعدد قليل جداً من جسيمات ألفا انحرفت عن مسارها، والنادر منها ارتدَّ إلى الخلف، وبالتالي ومن خلال هذه الملاحظة تبين أن معظم الذرة فراغ (وهذا يفسر عدم انحراف جسيمات ألفا). [1]
وتكون في مركز الذرة النواة (Nucleus) الموجبة الشحنة التي ترتكز فيها كتلة الذرة (وهذا يفسر انحراف عدد قليل من جسيمات ألفا)، وافترض رذرفورد بناءً على ذلك أن الإلكترونات تدور حول النواة في مداراتٍ دائريةٍ ثابتة. كان نموذج رذرفورد يُعرف أيضاً باسم نموذج رذرفورد الكوكب (Rutherford Planetary Model).

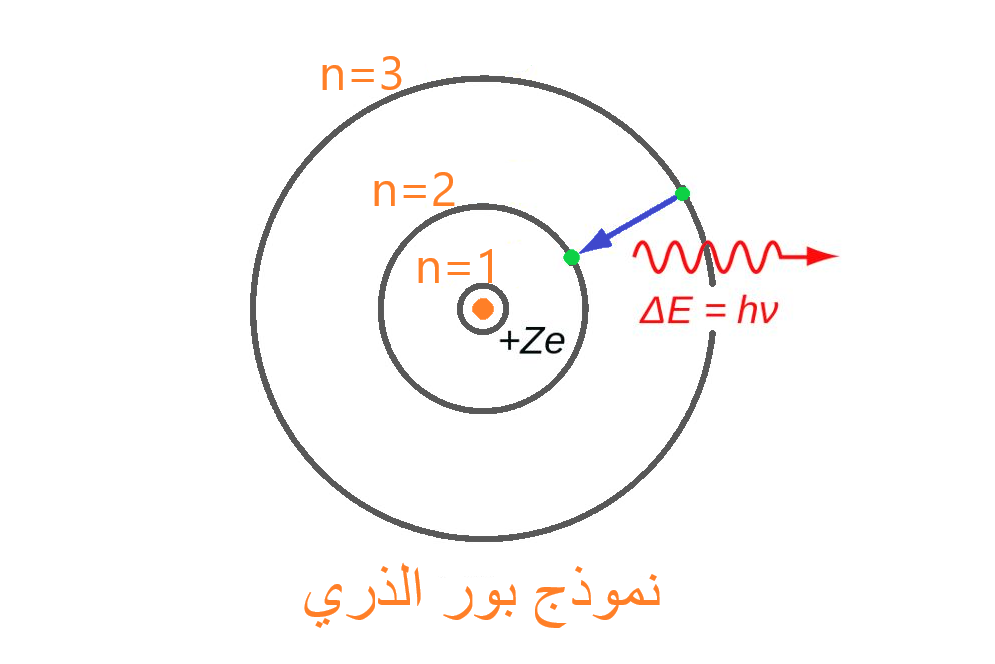
ما هو نموذج بور الذري؟
اقترح نيلز بور (Bohr) نموذجه الذري في عام 1915، ولأن نموذج بور هو تعديلٌ لنموذج رذرفورد السابق، فإن بعض الناس يطلقون على نموذج بور اسم نموذج رذرفورد-بور. يعتمد نموذج بور للذرة على ميكانيكا الكم، فعلى عكس النماذج السابقة، التي لم تتطرق لشرح فكرة إصدار الذرات للطاقة أو امتصاصها (الخطوط الطيفية الذرية) قام نموذج بور بشرح هذه الفكرة بشكلٍ دقيقٍ جداً.
نموذج بور هو نموذجٌ تدور فيه الإلكترونات حول النواة بمداراتٍ ليس من الضروري أن تكون دائريةً إنما لها أشكال مختلفة، وترتبط هذه الإلكترونات مع النواة من خلال قوة التجاذب الكهربائية بين الشحنات الموجبة (النواة) والسالبة (الإلكترون).
كما اعتبر بور أن لكل مدارٍ من المدارات له طاقة وقدرة محددة على استيعاب الإلكترونات، فليست كل المدرات تستوعب نفس العدد من الإلكترونات، وكلما ابتعدنا عن النواة زادت ضخامة المدار، وزاد عدد الإلكترونات التي ممكن أن يستوعبها.
نموذج بور وذرة الهيدروجين
أبسط مثال لنموذج بور هو لذرة الهيدروجين لما لهذه الذرة من خصوصية من حيث التركيب الذي يسهل دراسته، فهي تتكون من نواةٍ بسيطة تحوي بروتوناً واحداً وإلكتروناً واحداً يدور حولها، وقد بيَّن بور أن الإلكترون يمتصُّ طاقةً عندما ينتقل من مدارٍ أقرب للنواة إلى مدار أبعد عنها، وبالمقابل يُصدر هذا الإلكترون طاقةً على شكل إشعاعٍ كهرطيسي (فوتون) عندما ينتقل من مدارٍ ما إلى مدارٍ أخفض منه في الطاقة، وهذا الفوتون يمتلك طاقةً تساوي فرق الطاقة بين السويتين التي كان فيها، والتي انتقل إليها.
نموذج بور للذرات الأثقل
تحتوي الذرات الأثقل على عددٍ أكبر من البروتونات في النواة مقارنةً بذرة الهيدروجين. يعتقد بور أن كل مدار إلكترون يمكن أن يحتوي فقط على عددٍ محدّدٍ من الإلكترونات، وبمجرد امتلاء المستوى، سيتمُّ رفع الإلكترونات الإضافية إلى المستوى التالي. وهكذا. وكان أبرز تحسين لنموذج بور هو نموذج سومرفيلد (Sommerfeld)، والذي يسمّى أحياناً نموذج بور-سومرفيلد. [2]

ما هو نموذج شرودينجر الذري؟
ويُدعى أيضاً النموذج الكمّي للذرة الذي وضعه إيروين شرودنجر (Erwin Schrodinger) في عام 1926، حيث طور نموذجه الذري آخذاً بعين الاعتبار الطبيعة الموجية والجسيمية للإلكترون (الطبيعة المزدوجة)، ويصف الإلكترون بأنه موجةٌ ثلاثية الأبعاد في المجال الإلكتروني للنواة موجبة الشحنة. وعبر عن الحركة الموجية للإلكترون في هذا المجال بمساعدة معادلة تفاضلية شهيرة تعرف باسم معادلة شرودنجر الموجية (Schrodinger wave equation). [3]
المراجع البحثية
1- Primary Connections: Linking science with literacy. (n.d.). Retrieved November 15, 2023
2- Helmenstine, A. M., PhD. (2020, January 27). Bohr model of the Atom explained. ThoughtCo. Retrieved November 15, 2023
3- John, A. P. (2022, February 17). Quantum mechanical model of atom: Introduction, theory and explanation. Embibe Exams. Retrieved November 15, 2023



